显微镜技术是人类进入原子时代的标志。
它把一个全新的世界展现在人类的视野里,人们第一次看到了数以百计的“新的”微小动物和植物,以及从人体到植物纤维等各种东西的内部构造。它还有助于科学家发现新物种,有助于医生治疗疾病,正逐渐被研究人员采用,因为它能够在使用数百、数千甚至数百万种新化合物治疗后,对许多细胞的单细胞活性进行无偏倚的多参数可视化和量化。
显微镜技术在过去几十年所取得的惊人进步,使得HCI(高内涵成像,High content imaging)才成为可能。
具体来说,显微镜现在能够通过自动化程序获取大量图像。简单点说,HCI是一种基于图像的高通量细胞筛选方法,它将自动多色荧光成像与量化数据分析相结合,以同时评估2D和3D细胞培养中单个细胞的多种分子特征,以及其他生物样本类型。
高内涵成像(HCI)
“HCI”这一术语用于指代基于图像的主要基础自动化高通量技术。通常指单个细胞的多个分子参数/特征(使用荧光染料测量)可以同时被评估,例如细胞周期状态、细胞和核形态、细胞活性、受体内化、蛋白质聚集等。
HCI方法用于测量和监测表型变化,以优化发现和开发研究,以及早期的发现和高通量筛选(HTS),从而实现命中先导物和先导物的优化。最终目标是得出一系列可靠数据,通过更为直观地理解化合物与靶点在细胞水平上的相互作用,为后期做出是否继续的决定提供支持。
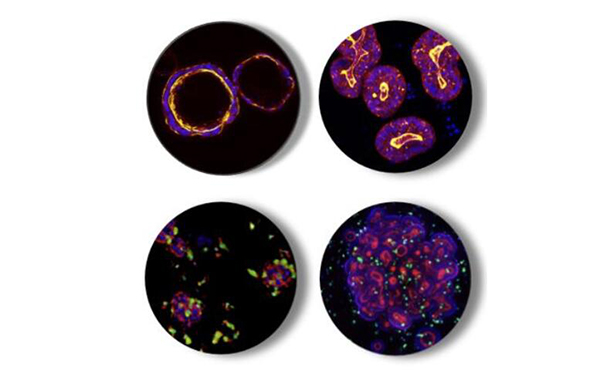
正常和癌症类器官单独和免疫细胞共培养的代表性多参数HCI图像
正常结肠类器官(左上)
结直肠癌类器官(右上)
类肿瘤加髓细胞(左下)
类器官加免疫细胞(右下)
高内涵筛选(HCS)
HCS,可称为高内涵成像与分析系统,是指在保持细胞结构和功能完整性的前提下,通过自动化细胞成像分析的方法,能快速、批量、自动地捕获细胞、亚细胞或组织图像,并对细胞表型进行量化处理,批量实现图片信息到数值信息的转换,实现了高通量图像信息的自动提取和分析。
HCS的目的类似于其他传统HTS(高通量筛选)方法,目标是筛选数百万种到数亿种化合物,确定新的药物靶点和命中率,或在复杂的细胞系统(包括球体和类器官等3D培养物)中进行靶点和先导物优化。
HCS采用高分辨率的荧光数码影像系统,可以获得被筛样品对细胞产生的多维立体和实时快速的生物效应信息,在细胞水平上检测多个指标的多元化,功能性筛选。与基于读板仪(酶标仪)的传统HTS相比,HCS被认为更具可预测性,因为高内涵成像(HCI)筛选法可显示细胞对化合物反应的表型数据,而其可能同一个实验中的在靶效应和/或脱靶效应有关。尽管在实验的规划阶段必须考虑可能出现的实验噪声、工作流挑战和数据存储容量,但通过使用多路复用技术,可以监控多个终点。

多个特征的HCS数据输出的代表性热图示例
(左)对细胞核和肌动蛋白的快速分析
(右)全z叠加分析在一次检测中产生300多种形态特征
虽然HCI硬件的发展速度非常快,但分析软件的发展速度却没跟上。这意味着HCS实验往往没有发挥其潜力。在应用方向上,根据相关研究,HCS的主要用途是小分子药物的发现(87%)、细胞行为或分化(59%)、细胞机理研究(57%)以及比较少的是细胞安全/毒理学研究(35%)。HCS在细胞活性、细胞周期、细胞迁移、毒性检测、受体蛋白转位、蛋白相互作用等许多方面都有很好的应用,是药物筛选等重要研究工具。
高内涵分析(HCA)
HCA将多参数算法应用于HCS数据,适用于从基础科学到药物发现筛选的一系列研究应用,可识别小分子、肽、RNAi、药物混合物或抗体的表型或靶反应。
基于高分辨率显微图像,HCA在保持细胞结构和功能完整性的前提下,同时检测被筛样品对细胞形态、生长、分化、迁移、凋亡、代谢途径及信号转导各个环节的影响, 在单一实验中获取大量与基因及其他细胞成分相关的信息, 确定其生物活性和潜在毒性的过程。因此该技术可作为一个强大的工具来研究生理活性物质(如化合物、siRNA、 肽和抗体)的影响,并可以培养如斑马鱼这样整个生物体的细胞和组织样本。
HCA通过在复杂细胞系统(包括来自球体、类器官和共培养物以及微环境的多细胞结构)的背景下开发详细的细胞生理学特征,实现对来自HCS的命中率进行优化这一目标。换言之,精密的HCA算法现在能够在HCS实验中对细胞系进行非常复杂的分析,最终提供具备高度可预测性和高度可转化性的临床前数据来预测体内效应。
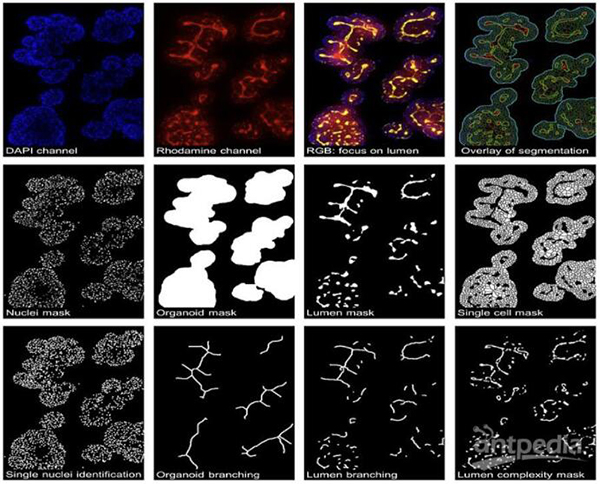
用于生成复杂细胞系统详细特征的类器官的HCA图像示例
高内涵成像/筛选/分析与类器官相结合的分析应用
类器官是微型化和简化的体外器官模型系统,是组织发育和疾病模型建立、个性化医学、药物筛选和细胞治疗等领域的研究热点。类器官又被称为迷你器官,这是一种被定义为体外培养的能够自我更新、自我组织,并具有来源组织器官功能的3D细胞簇,其来源于组织中的一个或几个细胞,例如胚胎干细胞(ESCs)、诱导多功能干细胞(iPSC)和成体干细胞(ASCs),这些干细胞可以扩展为多种组织类型。类器官通常包含细胞的共培养物并显示出高度的自组装性,因此与传统的二维(2D)细胞培养物相比,可以更好地显示复杂的体内细胞应答以及相互作用。
在类器官自动成像中,改善类器官表型变化的定量评估以及增加实验和检验中通量而言,类器官的自动成像和分析是非常重要的。共聚焦成像系统经常被用来深入评估类器官的形态。而3D类器官培养被视为HCS里最需要共聚焦模式成像的应用,共聚焦成像对于捕获3D生物检测分析的复杂性尤其有用。
如前所述,HCS可与类器官结合使用,其显著的临床可预测性与在原始组织中观察到的关键表型(如结构和细胞异质性)和遗传特征的重现有关。在肿瘤学项目的背景下,肿瘤类器官具有高度的临床相关性,是发现药物和生物标志物的良好平台。
基于图像的高通量技术能够开发具备高度可预测性和高度可转化性的临床前数据,以预测体内效应,尤其是与高度患者相关的3D类器官培养相结合时。高内涵分析工具能够确定和测定每个类器官中的单个细胞、细胞核或细胞器。并对活细胞、细胞或有特异性标记物的细胞进行计数,并且能够确定其体积大小以及彼此间的距离。
因此,3D类器官结构的成像系统需要满足的条件首先成像放大系统,照明的灵活性以及提高图像采集速度的模式。当空间尺度较小的细胞团成像时,需要的条件包括具有系统的高灵敏度,比如系统的高激发效率和成像检测器的高灵敏度。系统的高激发效率保证了只需要较低的激发光强度实现对整个细胞团的激发。其次便是成像系统能够高速成像。
目前,HCS系统正越来越多地用于3D细胞模型和表型分析的分析,在未来也将发挥着越来越重要的作用。



